猜你喜欢

第一作者:Xucheng Hou
通讯作者:Yizhou Dong
通讯单位:俄亥俄州立大学
研究背景:
传统上认为,脓毒症是对病原体的一种不可控的炎症反应。然而,最近的临床数据显示,超过60%的脓毒症患者在最初的炎症风暴中存活下来,但迅速发展成为更长的免疫抑制状态,其特征是免疫细胞瘫痪和死亡,导致无法清除入侵的病原体,增加了对医院获得性感染的易感性,并导致高死亡率。因此,为了治疗脓毒症,已经广泛研究了潜在的治疗靶点。
巨噬细胞是感染过程中最有效的病原体清除剂之一。事实上,在脓毒症患者中,巨噬细胞/单核细胞受损似乎是抗菌素防御不足的主要原因。几项免疫刺激剂的小型临床试验表明,在逆转失活的巨噬细胞/单核细胞,从而增强感染根除方面有益处。然而,大型临床试验的Meta分析没有显示在降低患者死亡率方面有显著变化。临床结果的差异可以解释如下。首先,免疫刺激剂不能将受损的巨噬细胞/单核细胞的功能恢复到原来的水平。其次,入侵的细菌通常被困在巨噬细胞吞噬溶酶体中,在巨噬细胞吞噬溶酶体中,活性氧、活性氮和溶菌酶协同作用清除细菌。然而,许多细菌,如金黄色葡萄球菌和大肠杆菌,已经进化出免疫逃逸机制来阻止吞噬酶体的杀伤,导致细胞内存活和反复感染。第三,虽然抗生素治疗是脓毒症临床指南中的标准治疗,但70-80%的脓毒症死亡与持续性感染有关,因此表明抗生素耐药性的流行和有效抗菌剂的缺乏。
成果简介:
近日,俄亥俄州立大学董一洲等研究人员研究表明,在溶酶体(MACs)中过继转移含有与组织蛋白酶B相连的抗菌肽的巨噬细胞可以用于治疗免疫抑制小鼠的多药耐药细菌诱导的脓毒症。MACs是通过转染维生素C脂质纳米粒来构建的,该纳米粒可以传递抗菌肽和组织蛋白酶B(AMP-CatB)mRNA。维生素C脂质纳米粒允许AMP-CatB在巨噬细胞溶酶体中特异性积聚,这是杀菌活性的关键部位。研究结果表明,过继的MAC转移可以消除包括金黄色葡萄球菌和大肠杆菌在内的多药耐药细菌,从而使免疫受损的脓毒症小鼠完全康复。

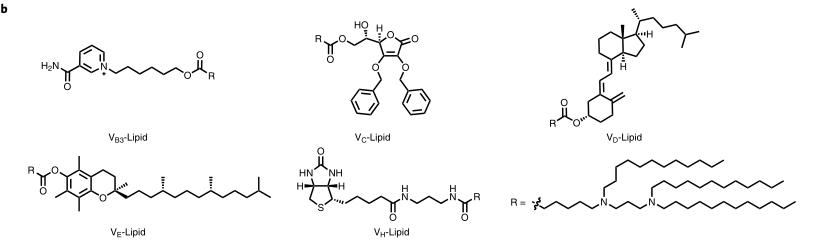
图1.过继巨噬细胞转移和维生素衍生脂质化学结构的示意图
要点1:过继巨噬细胞转移的机理和维生素衍生脂质的化学结构
首先设计并构建了编码抗菌肽IB367(AMP-IB367)、组织蛋白酶B(CatB)和CatB敏感接头的AMP-CatB mRNA。AMP-IB367是一种广谱AMP,具有快速杀菌活性,已在临床试验中得到证实。CatB是一种内源性溶酶体蛋白,最初被翻译为细胞质中的非活性前体。在转位到溶酶体中后,前体被加工成成熟的CatB。在本研究中,CatB组分被掺入以将AMP-IB367转运到溶酶体中。为了给巨噬细胞配备AMP-CatB mRNA,研究人员设计了一系列维生素衍生脂质纳米材料。如图1a所示,mRNA在细胞质中翻译成功能蛋白,这些蛋白进一步移位到溶酶体,在溶酶体中,连接子被CatB蛋白切割,从而释放APM-IB367。当包裹细菌的吞噬小体与溶酶体融合时,摄入的细菌同时暴露于预先储存的AMP-IB367和溶酶体抗菌成分。虽然免疫逃避策略可以保护MDR细菌免受吞噬酶体杀伤机制的影响,但AMP-IB367能够杀死这些细菌。因此,MACs过继转移通过恢复天然免疫,克服细菌免疫逃避,根除感染,从而挽救了MDR细菌诱导的脓毒症小鼠的免疫抑制状态。
要点2:VLNPs的筛选、优化和表征
在使用编码mRNA的萤火虫荧光素酶在RAW264.7细胞中进行的初始筛选中,VCLNPs的mRNA递送效率是其他四种荧光素酶的20倍(图2a)。此外,在相同的基因浓度下,VCLNPs比脂质体3000好10倍,比电穿孔好50倍(图2a)。此外,在6至24小时的处理时间过程中,在12小时观察到VCLNP组的最高发光强度(图2b)。为了进一步优化VCLNPs的配方,我们基于L16(4)4正交表制备了16种不同的配方。配方B2(脂质/2-二油酰基-sn甘油-3-磷酸乙醇胺(DOPE)/胆固醇= 30/30/40)出现在该研究中(图2c,d)。然后,研究人员通过与正交表中的顶级配方A10(脂质/DOPE/胆固醇= 30/30/50)进行比较来验证其递送效率。预测配方B2的发光强度显著高于配方A10 (P < 0.05,图2d,e)。在第二轮优化中,研究人员检测了配方B2的VC-脂质/ mRNA的质量比,从5/1到20/1(图2d)。当研究人员将VC-脂质/mRNA的质量比增加到15/1时,发光强度增强(配方C5,图2d,e)。为了测试CatB是否能够将有效载荷转运到溶酶体中,研究人员构建了增强型绿色荧光蛋白(eGFP)-CatB mRNA,并用VCLNPs将其转染RAW264.7细胞。活细胞的共聚焦图像显示,EGFP-CatB与LysoTracker Red DND-99共定位于溶酶体中,皮尔逊相关系数为0.93(图2g),表明CatB将其有效载荷携带到溶酶体中。在这些处理中,MAC-RAWs在测试的所有时间点显示出最强的杀菌活性,抑制率从33%到87%(图2h)。

图2.VLNPs的筛选、优化和表征图
要点3:MAC-RAWs对MDRSA诱导的免疫抑制脓毒症小鼠的治疗作用
由于免疫抑制脓毒症的致死性与不可治愈的病原体有关,研究人员在细胞转移24小时后测量了小鼠血液中的菌落形成单位(CFUs)。与PBS治疗相似,PBS-RAWs并未减少血液中的细菌负担,而MAC-RAWs (i.p.)和MAC-RAWs (i.p. i.v.)显著减少血液中的细菌菌落总数(分别P < 0.01和P < 0.001;图3a)。这些结果证实了MACS在体内的杀菌活性。此外,MAC- RAWs (i.p. i.v.)显示出比MAC- RAWs (i.p.)更强的清除细菌的能力(P<0.0001,图3A)。重要的是,与MAC-RAW(i.p. i.v., 58%)组相比,MAC-RAW(i.p.)组的生存率显著提高(P<0.01,图3b)。然后,研究人员对4只持续感染的小鼠进行重复治疗,从而清除这些小鼠体内的剩余细菌(图3g)。一个月后,7只存活小鼠的体重、白细胞和淋巴结水平完全恢复(图3c-e)。
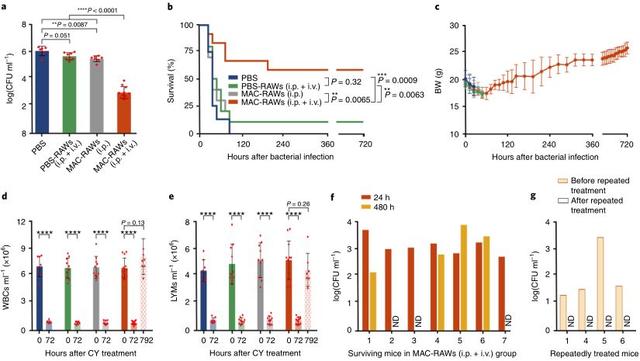
图3.MAC-RAWs对MDRSA诱导的免疫抑制脓毒症小鼠的治疗作用
要点4:MAC-BMDMs对免疫抑制多药耐药菌混合感染的脓毒症小鼠的治疗作用
由于脓毒症宿主通常暴露在混合细菌感染中,这对治疗脓毒症是一个艰巨的挑战,研究人员建立了一种同时由MDRSA和MDR大肠杆菌感染的小鼠脓毒症模型。与PBS或PBS-BMDM治疗相比,MAC-BMDM治疗显著降低了血液中的细菌负荷(图4a)。MAC-BMDM的治疗效果还体现在存活率(83%)上,明显高于PBS组(P<0.001)和PBS-BMDM组(P<0.05) (图4b)。最后,在所有存活的小鼠中观察到正常的体重、白细胞和LYM水平(图4c-f),在血液和主要器官中没有检测到持续性感染。
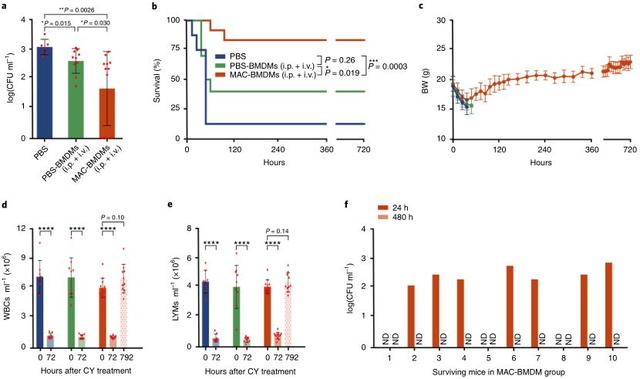
图4. MAC-BMDMs对免疫抑制多药耐药菌(金黄色葡萄球菌和大肠杆菌)混合感染的脓毒症小鼠的治疗作用
小结与展望:
综上所述,研究人员通过VCLNPs介导的mRNA传递开发了MACs。研究结果证实了MACs过继转移通过恢复先天免疫防御、防止细菌免疫逃逸和根除感染,有益地减轻了MDR细菌诱导的免疫抑制脓毒症小鼠的细菌负担,提高了小鼠的存活率。未来,这一平台将主要专注于免疫抑制剂治疗脓毒症晚期。自体巨噬细胞可能在大约一周内制备好,但病人的虚弱和脓毒症的紧急状态可能会使收集和工程自体巨噬细胞变得具有挑战性。随着诱导多能干细胞技术的进步,可能会制造出同种异体的“通用”巨噬细胞,使来自诱导多能干细胞的巨噬细胞能够成为包括脓毒症在内的临床应用的现成疗法。总体而言,MACs的过继转移可能为脓毒症和多药耐药细菌感染患者提供了一种治疗策略。
参加文献及原文链接:
Xucheng Hou, Xinfu Zhang, Weiyu Zhao, et al. Vitamin lipid nanoparticles enable adoptive macrophage transfer for the treatment of multidrug-resistant bacterial sepsis. Nature Nanotechnology, 2019.
DOI: 10.1038/ s41565-019-0600-1
https://www.nature.com/articles/s41565-019-0600-1
纳米生物医学最前沿
NanoLabs 微信公众号
你值得拥有