猜你喜欢
作者丨辛雨
R型细菌素是最小的可收缩的纳米机器,有望成为精确的抗生素。
每一种杀菌复合物都使用一个套环来连接一个中空管,该中空管具有由基板支架以亚稳态加载的可收缩鞘。
这种用于精密医学的无核酸蛋白质机器的微调,需要对整个复合物和收缩机制进行原子性描述,但是这在T4噬菌体(含DNA)的基板结构中是无法得到的。
4月15日,美国加州大学洛杉矶分校教授周正洪和Jeff F. Miller课题组在《自然》发表论文,报告了完整的R2脓菌素在收缩前和收缩后状态的原子模型,每个包含10个基因产物的11个独特原子模型的384个亚单位。

以可收缩纳米管为基础的机器广泛应用于细菌领域,其功能是穿透细胞膜,传递有效的蛋白质或DNA,或创建离子转移的通道。
收缩型分泌系统(T6SSs)将蛋白质分别注入真核细胞或细菌细胞中,以促进发病或杀死竞争对手。
以铜绿假单胞菌产生的R型脓毒杆菌为例的噬菌体尾巴样细菌素,利用同样的收缩力通过耗散其膜电位来杀死竞争细菌。
病毒噬菌体(如P2和T4)就是利用类似的收缩机制将DNA转移到细菌细胞中。
这些可收缩的纳米机器利用弹簧加载的鞘管组件穿透目标细胞表面。
这个过程伴随着大量的结构转变,包括由基板触发的鞘层收缩,这已经被单粒子低温电子显微镜和细胞低温电子层析成像所观察到。
虽然在噬菌体、脓菌素和T6SS中,能量的储存大多相似,但由于T6SS中存在额外的细胞膜,其触发机制可能不同。
相比之下,一些其他的传输系统,如T3SS和T4SS,不携带用于穿透的存储能量或用于触发的基板状结构。

基板从预收缩状态过渡到后收缩状态
先前报道的工程T4管-基板复合物显示了基板蛋白的静态结构,但缺乏鞘层来告知其如何接收收缩信号。
最近,来自Photorhabdus毒力盒和反食性原噬菌体的杀虫收缩毒素传递系统的低温电子显微镜结构,展示了这种噬菌体尾巴样收缩系统在自然界的广泛存在。
R型脓毒素相对简单,易于工程实现,是研究收缩结构的理想模型系统。
研究人员之前对R2脓毒素鞘和管在收缩前和收缩后的螺旋重建,揭示了收缩的能量是如何通过形状和电荷互补来储存和释放的。
然而,由于在基板和项圈上缺乏原子细节,因此无法了解引发鞘收缩的分子触发机制,也无法了解由此产生的结构是如何稳定下来以促进杀菌的。
在该研究中,研究人员从单粒子低温电子显微镜和x射线晶体学报告了脓毒素在收缩前和收缩后的原子模型,推导并测试了杀菌纳米机器的作用模型。
这些结构的比较表明,脓菌素收缩期间发生了以下一系列事件:尾纤维触发了基板三联体的侧向分离;分离后引发一系列导致鞘收缩的事件;这种收缩将化学能转化为机械力,推动铁头管穿过细菌细胞表面,杀死细菌。
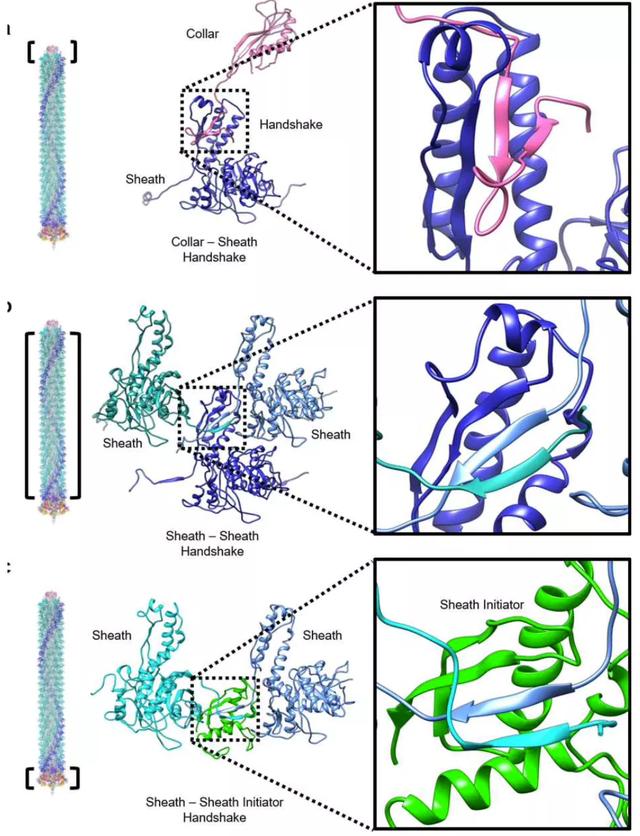
脓菌素中鞘层的三种构象类型
研究人员表示,该模型将目标细胞的特定识别与杀伤机制的通用部署结合起来,为利用这些结构作为精确抗菌剂提供了至关重要的信息。
在原子模型的基础上,研究人员构建了一个最小的收缩机,这个收缩纳米机器包括12个鞘层,可以呈现R2脓菌素两种状态之间的变形。
值得注意的是,由于收缩鞘的存在,管在动力冲程中发生的旋转运动,可能有助于刺突穿透目标细胞表面。
R型脓毒杆菌素和相关的R型细菌素正在作为一类新的抗菌素被开发。
它们的结构的一个独特之处在于,受体结合蛋白赋予的高度特异性的目标识别直接与作用机制相结合。
这种精细的特异性使我们能够选择性地杀灭病原体,而不会产生诸如菌群失调等脱靶效应的意外后果,也不会在脱靶的细菌物种或菌株中选择可传播的抗生素耐药性。
工程受体结合蛋白改变R型脓菌素结合的特异性已经被证明。
研究人员表示,对于那些需要从复杂的细菌生态系统中精确地消融病原体的应用,一个较不敏感的触发将会最小化脱靶效应,并且只有在与正确的细菌细胞紧密结合时才会触发杀死机制。
相反,在完全感染的情况下(如败血症),单个病原体已经生长到高密度,一个更敏感的触发将允许更有效地杀死与目标的碰撞。
相关论文: