猜你喜欢
*今日头条上无法显示上标、下标,欲获得更好的阅读体验请前往微信公众号。
*前往“纳米酶Nanozymes”公众号,了解有关纳米酶的最新消息!
*本文首发于“纳米酶Nanozymes”公众号,2022年3月26日
*编辑:俞纪元
背景介绍
2021年统计数据表明,前列腺癌(PCa)位居男性癌症发病率第二位和死亡率首位,已成为危害男性健康的重大疾病。对前列腺癌早期的检测和防治是降低患者死亡率的有效手段。目前临床上一般通过检测血清中前列腺特异性抗原(PSA)水平实现前列腺癌的筛查。然而,血清PSA检测存在假阳性率高,导致PCa患者可能要进行穿刺活检,需要承担额外的风险和过度治疗。肌氨酸(Sar)作为一种重要的代谢产物,因其在前列腺癌的进展和转移过程中的高水平而受到越来越多的关注。 有研究表明,肌氨酸水平可有效区分良性、局部和转移性前列腺癌。 因此,肌氨酸被认为是一种可用于前列腺癌非侵入性筛查的生物标志物。多种肿瘤标志物的联合检测较单一标志物检测假阳性率更低,并且可以丰富检出指标组合,综合评估癌症患者的情况,为临床诊断提供更多的信息。因此选择前列腺特异性抗原和肌氨酸作为目标物,设计可以同时检测前列腺癌双肿瘤标志物的高灵敏度传感器可以提高前列腺癌诊断的准确性。
上海工程技术大学鲁娜研究员课题组开发了一种基于MoS2纳米结构和信号放大的电化学适配体传感器用于同时检测前列腺癌(PCa)双肿瘤标志物,相关成果以“Simultaneous detection of dual biomarkers using hierarchical MoS2 nanostructuring and nano-signal amplification-based electrochemical aptasensor toward accurate diagnosis of prostate cancer”为题发表于Biosensors & Bioelecronics ,该工作的第一作者为上海工程技术大学硕士研究生严若鸿,上海工程技术大学的鲁娜研究员为通讯作者。此项研究得到了国家自然科学基金面上项目、上海高校特聘教授(东方学者)岗位计划和上海市“科技行动创新计划”青年优秀学术带头人计划的资助支持。
研究内容
设计了基于MoS2纳米结构和SiO2纳米探针的电化学适体传感器,用于同时检测前列腺癌双肿瘤标志物。传感原理如图1所示,首先将MoS2纳米花修饰在玻碳电极(GCE)表面,作为功能性生物传感界面。MoS2纳米花具有跨尺度仿生微纳米多级结构,有利于DNA的捕获和目标分子的识别。设计同时包含多聚胞嘧啶(polyC)和适体序列的DNA作为捕获探针,并通过polyC与MoS2的之间范德华力等物理作用将探针DNA修饰在电极表面。采用电化学氧化还原指示剂和探针DNA同时修饰的SiO2纳米粒子作为纳米探针,通过一步法实现两种靶标分子的同时检测。在靶标分子不存在的情况下,捕获DNA和探针DNA相互杂交形成DNA双链,使得SiO2纳米探针在电极表面,此时有明显的电化学信号产生。在靶标分子存在的情况下,由于靶标分子与捕获DNA的适体序列特异性结合,导致双链DNA解螺旋,使得SiO2纳米探针被释放并远离电极界面,导致电化学信号显著降低。当两种肿瘤标志物PSA和肌氨酸同时加入时,同时释放两种SiO2纳米探针,从而同时产生两种电化学氧化还原指示剂的信号变化。靶标分子的加入浓度与电化学信号的减小成一定的函数关系,从而实现靶标分子的定量分析。这里提出的电化学适体传感器通过MoS2多级结构和基于SiO2纳米探针的信号放大,实现了对两种肿瘤标志物的一步、高效和高选择性的同时检测。

图2. MoS2纳米花、SiO2纳米探针合成以及可行性验证
利用亚甲基蓝(MB)和PSA 适体DNA(PMB)同时修饰的SiO2纳米粒子(SiO2@MB@PMB)作为信号探针,结合了MoS2纳米电极界面,构建了用于检测PSA的电化学适体传感器(图3)。为了得到PSA最佳传感体系,设计了两种不同的捕获探针DNA序列,分别与SiO2纳米探针上的识别DNA杂交。结果表明,当DNA杂交部分更靠近电极表面时,PSA加入后电化学信号下降相对更大。对DNA序列的二级结构的杂交动力学研究也表明,DNA杂交部分更靠近电极端具有更低的吉布斯自由能。通过实验条件优化,得到了SiO2最佳探针浓度为150 μg/mL,最佳孵育时间为120 min。最佳实验条件下,实现了PSA 1 fg/mL-500 ng/mL的检测范围,检测限(LOD)低至1.21 fg/mL,并且该方法对对照蛋白质标志物具有良好的选择性。

图3. PSA传感器的构建与优化
将二茂铁(Fc)和肌氨酸适体DNA(PFc)同时修饰的SiO2纳米粒子(SiO2@Fc@PFc)作为信号探针,结合了MoS2纳米电极界面,构建了用于检测肌氨酸的电化学适体传感器(图4)。为了得到肌氨酸最佳传感体系。设计了两种不同的DNA互补配对体系,其中四种不同的捕获探针DNA序列,分别与SiO2纳米探针上的两种识别DNA杂交。结果表明,肌氨酸加入后电化学信号下降程度受纳米探针的空间位阻影响更大。对DNA序列的二级结构的杂交动力学研究表明,同体系中吉布斯自由能更低的在加入肌氨酸后信号变化更大。通过实验条件优化,得到了SiO2最佳探针浓度为200 μg/mL,最佳孵育时间为60 min。最佳实验条件下,实现了肌氨酸 1 fg/mL-1 μg/mL的检测范围,检测限(LOD)低至3.4 fg/mL,并且该方法对对照蛋白质标志物具有良好的选择性。

图4. 肌氨酸传感器的构建与优化
最佳检测体系和实验条件下,通过制备的两种SiO2纳米探针构建了可同时检测前列腺癌双重肿瘤标志物-PSA和肌氨酸的电化学适体传感器。交叉性反应实验表明,在只有一种抗原存在情况下,仅有对应的一种电化学信号发生变化;两种靶标分子同时存在下,相应的两种电化学信号均发生下降,说明两套适体/抗原体系之间的干扰性较小。该传感体系实现了对PSA和肌氨酸的同时检测,范围分别为1 fg/mL-500 ng/mL和1 fg/mL-1 μg/mL,LOD值分别为2.5 fg/mL和14.4 fg/mL,并且该传感体系具有良好的选择性(图5)。此外,该传感器能应用于50%人血清样品中PSA和肌氨酸最低10 fg/mL的检测。更重要的是,该传感器用于临床血清样本的检测,对于健康人和患者的样本有良好的区分能力(图6)。
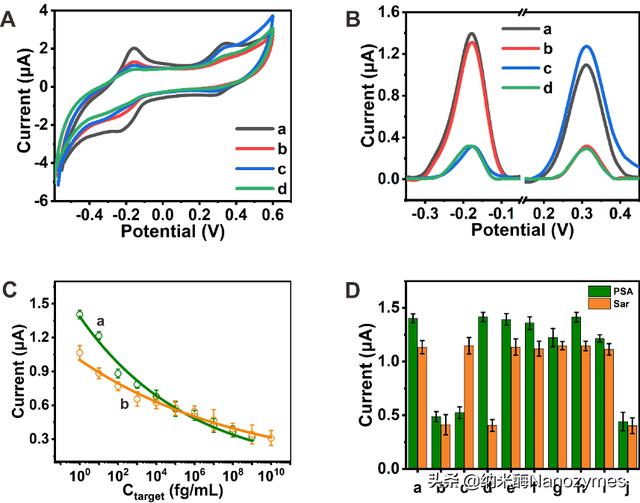
图5. 双目标物传感器同时检测PSA和肌氨酸

图6. 双目标物传感器检测临床样本
总结
以多级MoS2纳米结构修饰的玻碳电极作为功能纳米界面,通过同时负载电化学活性探针和适体的硅纳米粒子进行信号放大和靶标分子识别,构建了用于同时检测前列腺癌双标志物PSA和肌氨酸的电化学适体传感器。通过体系和条件优化,分别构建了PSA和肌氨酸的电化学适配体传感器,并分别探究了其灵敏度和选择性。在最佳检测体系和实验条件下,通过制备的两种SiO2纳米探针构建了可同时检测前列腺癌双肿瘤标志物PSA和肌氨酸的电化学适配体传感器。该传感体系实现了对PSA和肌氨酸的同时检测,检测范围分别为1 fg/mL-500 ng/mL和1 fg/mL-1 μg/mL,LOD值分别为2.5 fg/mL和14.4 fg/mL,并且该传感体系具有良好的选择性。此外,该传感器能应用于50%人血清样品中PSA和肌氨酸最低10 fg/mL的检测。更重要的是,该传感器可用于临床血清样本的直接检测,对健康和前列腺癌患者的血清样本有良好的区分能力。用于同时检测的适配体传感器可以直接应用于实际的临床样本中,具有很高的性能,为前列腺癌的筛查提供了一种简单、一步到位、低成本的方法,同时也推进了前列腺癌早期诊断的研究。
往期推荐
Nanoscale | 一种用于根除耐药细菌生物膜感染的DNase人工模拟酶
Anal. Chem. | AuPtCo三元合金纳米酶用于化学发光生物分析
撰稿:严若鸿
审核:王一权
编辑:王嘉正