猜你喜欢
癌细胞远端器官转移是肿瘤患者最为常见的死因。其中,肝脏由于其丰富的血供,成为癌转移的最佳器官。手术切除是目前唯一的根治性手段,但其仅适用于具有单一转移病灶的患者,并对于病灶的尺寸具有严格的限制。满足上述条件的病患往往只占到肝转移癌患者一小部分,大多数患者在被确诊时往往已在肝内形成数个至数十个大小不一的转移灶(弥散性肝转移),因而无法被根治性切除。对于这类患者,仅能采取化疗为主的姑息性治疗,生存收益有限且患者需要承受严重的肝功能损伤。如何在选择性清除转移灶的同时又能最大限度实现对于肝功能的保护成为了一项具有重大临床意义的研究课题。近年来,纳米靶向药物为转移癌的治疗带来了曙光,但癌转移过程中肿瘤细胞标志物丢失或者结构突变等问题,限制了纳米靶向药物的实际应用效果。
针对这一问题,南京大学现代工程于应用科学学院胡勇课题组与南京大学化学化工学院蒋锡群课题组,加州大学洛杉矶分校顾臻课题组展开国际合作,提出了一种不依赖标志物的肝转移癌治疗手段,有效清除癌细胞的同时最大限度保全肝细胞功能。
研究人员选取了多孔硅作为光动力药物的载体(A unit),通过Cathepsin B酶响应性氨基酸链段将非化学计量比氧化钨纳米球(B unit)偶联至硅球表面,形成一种行星-卫星结构。其工作原理如图一所示,肿瘤细胞内高酶切活性导致了A,B units的分离,并促成二者最终分别富集于线粒体和细胞核内。通过次序给予激光照射,经由线粒体和细胞核调控的氧化磷酸化和无氧糖酵解均被抑制,切断了癌细胞的能量来源—ATP的产生。正常的肝细胞及库普弗细胞(Kupffer cells)缺乏足够的酶切活性,纳米载体的结构得以维持,这导致第一步激光照射产生的活性氧被卫星状分布的非化学计量比氧化钨所吸收。在第二轮激光照射中,作为光热发生介质的B unit由于在第一轮与活性氧作用下,作为活性中心的W(IV)被氧化,而丧失了光-热转化能力,最终保护正常组织免受热损伤。
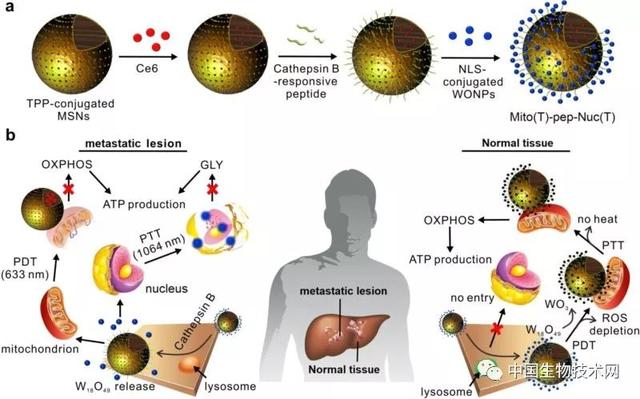
图2. KEGG信号通路
该成果近日以《Eradication of unresectable liver metastasis through induction of tumour specific energy depletion》为题发表在《自然·通讯》(Nature Communications)杂志上。南京大学现代工程与应用科学学院为本文第一通讯单位。现代工程与科学学院15届博士生霍达为本文第一作者,胡勇教授,蒋锡群教授和顾臻教授为本文共同通讯作者,该工作的顺利开展得到了胡勇教授课题组博士生朱剑峰,张超,蒋炜,罗星谕以及加州大学洛杉矶分校顾臻教授课题组陈国军博士和苏州大学陈倩教授的大力支持。
该项研究得到国家重点研发计划,国家自然科学基金,及南京大学优秀项目探索计划基金的支持。
注:国内为原创研究成果或评论、综述,国际为在线发表一个月内的最新成果或综述,字数500字以上,并请提供至少一张图片。投稿者,请将文章发送至weixin@im.ac.cn。
本公众号由中国科学院微生物研究所信息中心承办
微信公众号:中国生物技术网回复关键词“热点”可阅读热点专题文章,包括“施一公”、“肠道菌群”、“肿瘤”、“免疫”和“健康”